Verdünnung herstellen
Als Verdünnung bezeichnet man den Vorgang des Verdünnens, das heißt das Zusetzen eines Lösungsmittels zu einer Lösung. Das Volumen der Lösung steigt dabei, die Konzentration der in ihr gelösten Stoffe sinkt. Auch das Resultat, die verdünnte Lösung oder auch Verdünnungsstufe, wird Verdünnung genannt. Mehrere Verdünnungen derselben Ausgangslösung werden als Verdünnungsreihen bezeichnet. Die offizielle Formel zur Berechnung einer Verdünnung ist c1V1 = c2V2, wobei c1 und c2 die Konzentrationen der Ausgangs- bzw. Endlösungen darstellen, und V1 und V2 ihre Volumen bedeuten. In der Chemie bedeutet „eine Verdünnung herstellen“ gewöhnlich, dass einer kleinen Menge einer Lösung bekannter Konzentration eine neutrale Flüssigkeit (wie Wasser) hinzugefügt wird, um eine neue Lösung mit höherem Volumen und niedrigerer Konzentration zu erhalten.
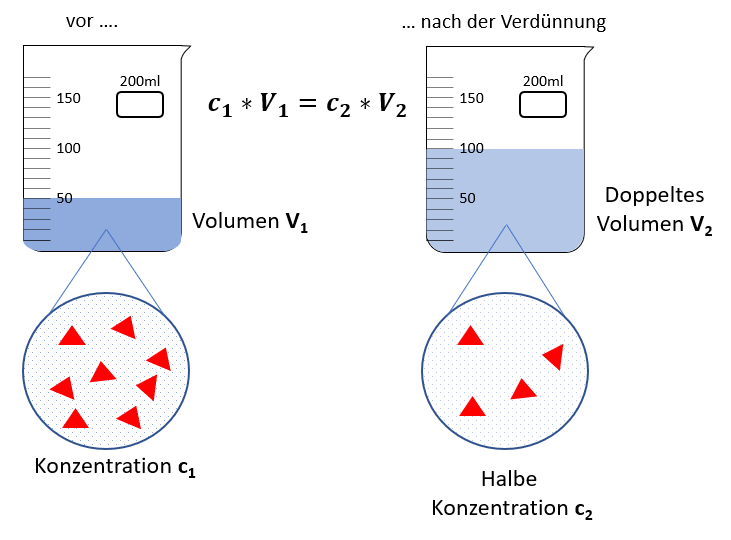
Wird der enthaltene Stoff oder das Volumen verändert, also beispielsweise erhöht oder reduziert, verändert sich die Konzentration.
Eine Verdünnung von beispielsweise 1:10 bedeutet, dass 1 ml einer Substanz mit Lösungsmittel auf ein Endvolumen von 10 ml aufgefüllt wird. Dabei sinkt die Endkonzentration auf ein Zehntel der Ausgangskonzentration. Daher wird sie auch als Mischung von einem und 9 Volumenanteilen bezeichnet.
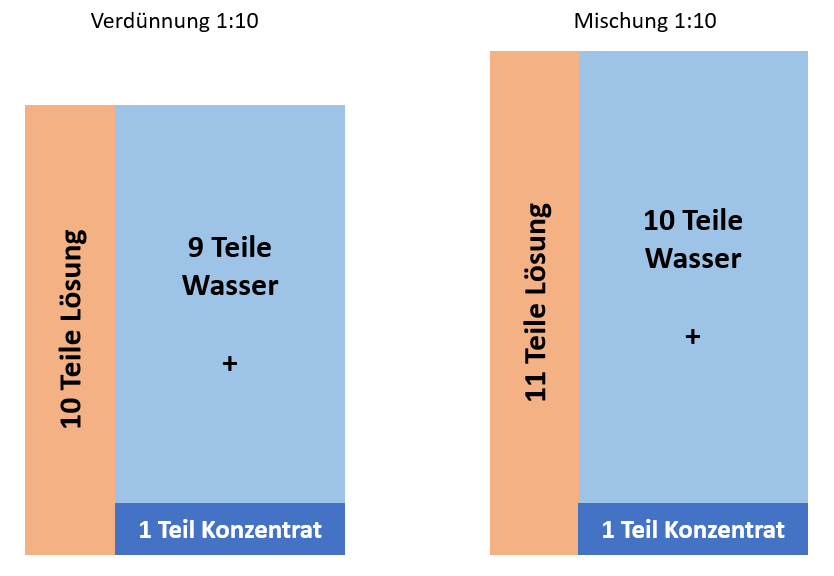
Unterschied zwischen Verdünnung und Mischung am Beispiel 1:10
Mit Hilfe der Verdünnung kann die Konzentration der Stammlösung (Ausgangslösung) gezielt verringert und eine Lösung mit einer bestimmten Zielkonzentration erzeugt werden.
Somit haben Sie eine praktische Methode zur Hand, um die Konzentrationsverhältnisse zweier oder mehrerer Lösungen für eine Mischung zu berechnen.
Verdünnungsreihen
Eine Verdünnungsreihe ist die Gesamtheit von Lösungen, die aus einer konzentrierten Ausgangslösung durch Verdünnen hergestellt wurden. Dabei unterscheiden sich die als Verdünnungsstufen bezeichneten Lösungen in ihrem Gehalt (beispielsweise in der Stoffmengenkonzentration oder der Massenkonzentration).
Bei den Verdünnungsreihen unterscheidet man solche, bei denen die einzelnen Verdünnungsstufen durch Verdünnen der vorangegangenen Verdünnungsstufe hergestellt werden (fortgesetztes Verdünnen, serielles Verdünnen oder geometrische Verdünnung), und solche, bei der alle Verdünnungsstufen direkt aus der Ausgangslösung hergestellt werden (paralleles Verdünnen, Arithmetische Verdünnung). Für die Herstellung von niedrig konzentrierten Lösungen, wie die Spurenelementlösungen, wenden wir die geometrische Verdünnung an.
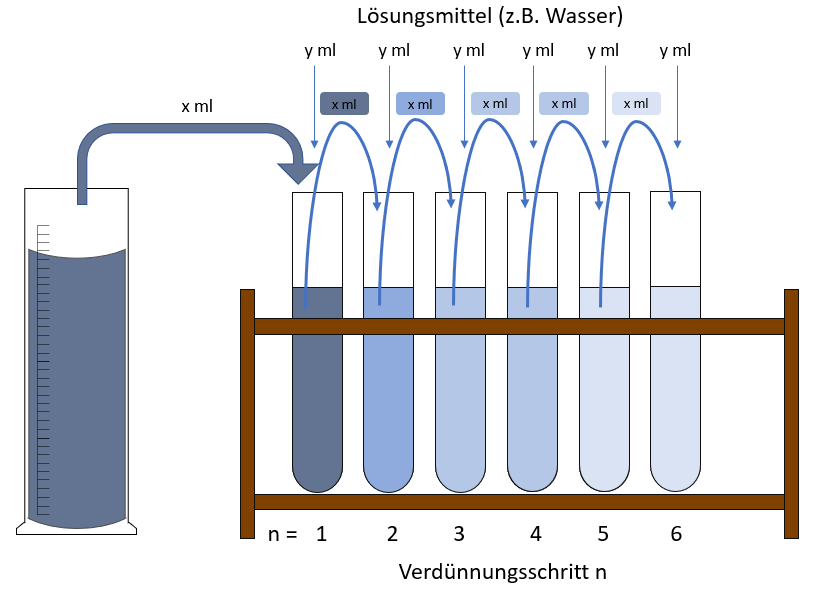
Verdünnungsreihen durch fortgesetztes Verdünnen (Geometrische Verdünnung)
Nimmt man beispielsweise 10 ml einer Ausgangslösung und mischt diese mit Lösungsmittel (beispielsweise Wasser), so dass 100 ml entstehen, so besitzt diese 1. Verdünnungsstufe nur noch ein Zehntel der Konzentration der Ausgangslösung. Nimmt man von der ersten Verdünnungsstufe wiederum 10 ml heraus und verdünnt wieder auf 100 ml, so besitzt die 2. Verdünnungsstufe nur noch ein Hundertstel der Konzentration der Ausgangslösung. Verdünnt man diese Lösung auf gleiche Weise, so entsteht eine 3. Verdünnungsstufe mit einem Tausendstel der Konzentration der Ausgangslösung. Besitzt die Massenkonzentration der Ausgangslösung beispielsweise 1 g/l, so sind die Konzentrationen der Lösungen der Verdünnungsreihe hiermit 0,1 g/l (1. Verdünnungsstufe); 0,01 g/l (2. Verdünnungsstufe); 0,001 g/l (3. Verdünnungsstufe). Dies kann man beliebig weiterführen. Pro Schritt wird die Konzentration um eine Zehnerpotenz kleiner. Unterscheiden sich die Konzentrationen der einzelnen Verdünnungsstufen wie in diesem Fall um den Faktor 10, so spricht man auch von einer dezimalen Verdünnungsreihe. Die mathematische Formel für die Berechnung der Konzentrationen bei einer fortgesetzten Verdünnungsreihe lautet wie folgt:
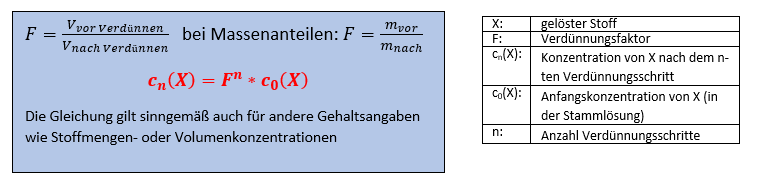
Der Verdünnungsfaktor F ist im obigen Bild ist x/(x+y). Im Beispiel wäre x=10ml vor dem Verdünnen und x+y= 10ml+90ml=100ml nach dem Verdünnen, so dass wir einen Verdünnungsfaktor von 0,1 haben.
Im folgenden wird ein Beispiel durchgerechnet, wie eine hochkonzentrierte Lösung verdünnt wird. Als Produkt wird das OSCI-MOTION Trace Element Iod verwendet. Dies enthält 75 g/l Iod (I), dies entspricht 75.000.000 µg/l.
c0(X) =75g/l ist die Konzentration der Stamm- bzw. Ausganglösung, cn(X) die Konzentration der Ziellösung bzw. Arbeitslösung nach dem n-ten Verdünnungsschritt und F der Verdünnungsfaktor, welcher in unserem Falle F = 1ml / (1ml+99ml) = 1ml / 100ml = 0,01 ist. D.h. Auf 99ml Osmosewasser wird 1ml der Iodlösung hinzugegeben.
- Mit einer Verdünnung (n=1) wäre die Konzentration der Ziellösung c1(X)= 0,011 * 75g/l = 0,01 * 75g/l = 0,75g/l = 750mg/l = 750.000µg/l
- Mit einer weiteren Verdünnung (n=2) wäre die Konzentration der Ziellösung c2(X)= 0,012 * 75g/l = 0,0001 *75g/l = 0,0075g/l = 7,5mg/l = 7.500µg/l
- Mit einer weiteren Verdünnung (n=3) wäre die Konzentration der Ziellösung c3(X)= 0,013 * 75g/l = 0,000001 *75g/l = 0,000075g/l = 0,075mg/l = 75µg/l
Um eine verwendbare Arbeitslösung zu erhalten, reicht es aus einmal zu verdünnen. 1ml der Lösung nach der ersten Verdünnung enthält 750µg. Auf 100 Liter umgerechnet sind das 7,5µg.
Beispiel: In einen 450 Liter Aquarium wird eine Iod Konzentration von 55µg/l gemessen. Die optimale Iod Konzentration liegt bei 65µg/l; es liegt ein Iod-Defizit von 10µg/l vor. Man möchte auf 65µg/l mit der Arbeitslösung erhöhen. Wieviel ml der Arbeitslösung muss man auf das 450 Liter Aquarium hinzugeben,
Ergebnis: Man muss 6ml der Arbeitslösung hinzugeben.
Rechenweg: (1ml / 750µg) * 10µg * 450 = 6ml